간으로 전이된 폐암환자 임상시험 결과
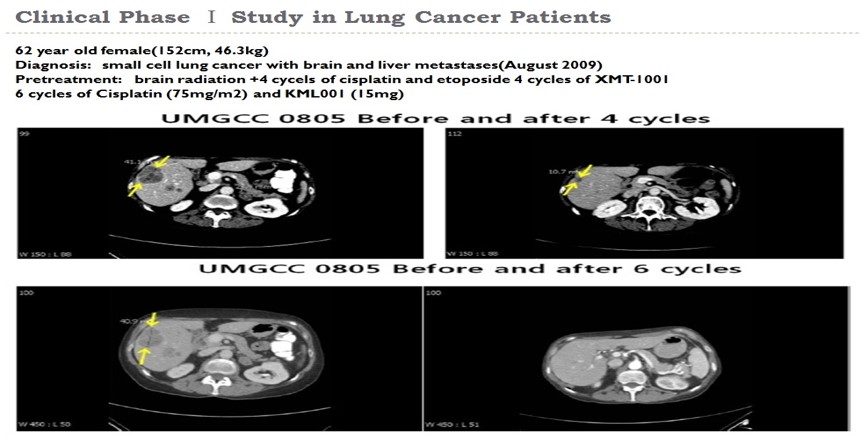

고형암 I상 임상시험 결과(Korea)
| Clinical Phase I 고형암1상 임상(Korea) | |||||||||||||||||||||||||||||||
| 제목 | 불응성 또는 재발성 고형암 환자에서 경구용 코미녹스(Kml001) 단독 치료의 안정성 및 내약성 평가를 위한 제1상 임상시험 |
||||||||||||||||||||||||||||||
| 피험자수 | 4주 단독요법의 안정성 평가
코미녹스 단독 투여 시 최대내약용량 및 권장 용량 결정. |
||||||||||||||||||||||||||||||
| 용법용량 | 4주 투약 + 1주 휴약
|
||||||||||||||||||||||||||||||
| 유효성 결과 | 4주 단독요법의 안정성 평가
뛰어난 내약성 확인
코미녹스 단독 투여시 최대내약용량 및 임상 2상을 위한 적정 용량 확인 |
||||||||||||||||||||||||||||||
전립선암 I상 임상시험 결과(Germany)
| Clinical Phase I 전립선암 1상 임상(Korea) | |
| 제 목 | 불응성 또는 재발성 고형암 환자에서 경구용 코미녹스(Kml001) 단독 치료의 안정성 및 내약성 평가를 위한 제1상 임상시험 |
| 피험자수 | 진행성, 호르몬 불응성 전립선암 환자 대상의 안정성 · 유효성 평가를 위한 임상 1상 |
| 용법용량 | 진행성, 호르몬 불응성 전립선암 환자 35명(평균 연령 = 73세 [59-84]) |
| 평가변수 | 2.5mg ~ 20mg, 14일 투여 후 28일 휴약 |
| 독성프로필 | 1차 : 최대 허용용량결정 및 독성평가
2차 : 유효성 평가, 삶의 질 평가, 약동학 연구 |
| 유효성 결과 | 뛰어난 내약성: 용량 제한 독성 관찰되지 않음. 32명중 4명에서 일시적인 등급 1-2의 GOT/GPT 증가. As203 임상 중 10% 환자 이상에서 관찰되는 독성 관찰되지 않음 : 심장박동(QT/QTc) 이상, 심한 피로, 고열, 부종, 흉통, 걱정, 우울증 |
| 유효성 결과 | 질병조절율 (CR+PR+SD): 66% |
코미녹스에 대한 전체 환자 (35명) 반응율(RECIST 기준)
| 뼈전이가 있는 환자와 없는 환자 전체 수 | 35(100%) |
| 부분 반응을 보인 환자 수(PR) | 18(51%) |
| 암의 중지를 보인 환자 수(SD) | 3(9%) |
| 완전 반응을 보인 환자 수(CR) | 2(6%) |
| 암의 진행을 보인 환자 수(PD) | 12(34%) |
코미녹스에 대한 전체 환자 (35명) 반응율(RECIST 기준)
| 뼈전이가 있는 환자와 없는 환자 전체 수 | 7(100%) |
| 부분 반응을 보인 환자 수(PR) | 6(86%) |
| 암의 중지를 보인 환자 수(SD) | 0 |
| 완전 반응을 보인 환자 수(CR) | 0 |
| 암의 진행을 보인 환자 수(PD) | 1(14%) |
임상 II상 임상시험 결과
| Clinical Phase II 전립선암 2상 임상(Korea) | |
| 제 목 | 골전이가 있는 전립선암 환자에 대한 kml001(KOMINOX)의 제 2 상 임상시험 |
| 피험자수 | 13명 등록 (평균나이 : 66.9세, 체중 : 70.3kg) |
| 용법용량 | 17.5mg, 14일 투약 후 7일 휴약 |
| 평가변수 | 1차 : 기저치로부터 최소한 50% 감소로 정의된 PSA 반응
2차 : PSA 진행(기저치로부터 20%를 초과하는 PSA 증가로 정의 됨)까지의 시간 |
| 유효성 결과 | PSA 반응율 50% 환자: 4명, PSA 반응율 30% 환자: 4명 |
| 간암 2상 임상(Korea) | |
| 제 목 | 전신 항암 치료에 실패한 전이성 또는 국소 진행성 간암 환자에서 코미녹스(Kml001)의 유효성 및 안전성 평가를 위한 단독투여, 비비교, 공개, 다기관, 2상 임상시험 |
| 목 표 | 4주 단독요법의 안전성 평가
질병 진행까지의 시간(TTP)와 이상반응 확인을 통해 유효성 및 안전성을 평가 |
| 용법용량 | 4주 투약 + 1주 휴약
내약성에 따라 증감 가능하며, 총 5 cycles |
| 진행현황(2015. 09기준) | 임상완료(진행율 100%), 질병조절율 36.0% |
응급의약품으로 공급받은 환자의 치료 결과(Korea)
한국의 응급의약품 제도
[관련법규 [의약품 임상시험 계획 승인지침] 제12조(응급상황의 임상시험용의약품 사용 등)의 내용 중]
".... 임상시험용의약품 또는 시판허가 되지 않은 의약품을 대상환자의 동의를 받아 의사의 책임하에 사용하고자 하는 경우에는 다음 각 호의 자료를 제출하여 식품의약품안전청의 사용승인을 얻어야 한다"
- 환자의 진료기록 및 전문의 소견에 대한 요약자료
- 진단서
- 환자의 동의서
- 개발사의 공급의향서
암 진행중지(SD) / 암세포 축소(PR) / 완전관해(CR) 등의 효과 확인
응급의약품 공급 대상 암환자 및 복용결과
| 담관암 환자 5명 | 암중지(SD) |
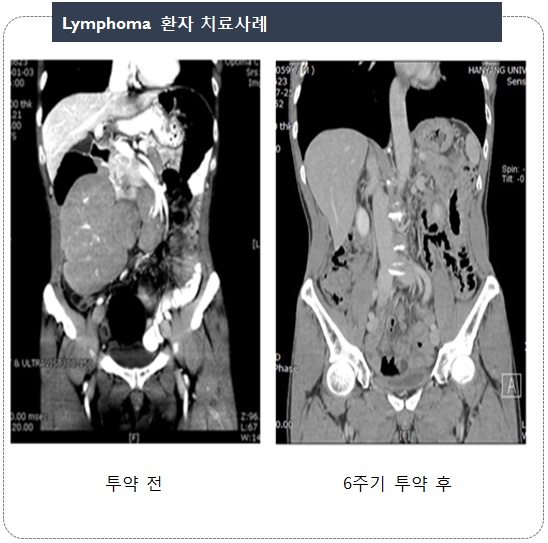
| Lymphoma 환자 3명 | 암세포 축소(PR) |
| 육종암 환자 1명 | 암중지(SD) |
| 췌장암 환자 1명 | 암중지(SD) |
| 다발성 골수종 환자 1명 | 암중지(SD) |
| 다발성 골수종 환자 1명 | 암세포 축소(PR) |
| 다발성 골수종 환자 1명 | 완전관해(CR) |
| 뇌전이 폐암 환자 1명 | 완전관해(CR) |
