1특징 및 장점
2기존 비소제제와의 차이
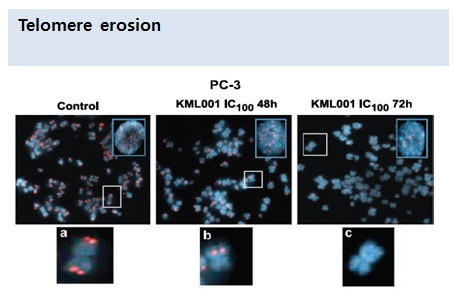
 3작용기전-암세포 텔로미어 공격
3작용기전-암세포 텔로미어 공격
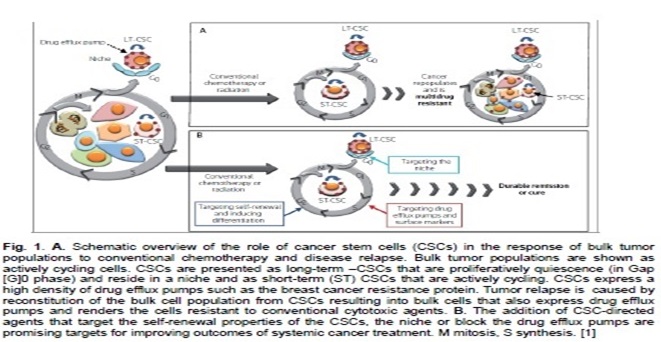
 4작용기전-암줄기세포 공격
4작용기전-암줄기세포 공격
 5항암효과 : 동물모델에서의 항암 효과
5항암효과 : 동물모델에서의 항암 효과
 6항암효과 : 암세포 사멸 실험 결과
6항암효과 : 암세포 사멸 실험 결과

| 구분 | 설명 |
| Identification | Kml001 (Kominox) |
| 화학물질명 | Sodium metaarsenite |
| 분자식 | NaAsO2 |
| 분자량 | 129.9 g/mol |
| 순도 | > 99.8% |
| 물에서의 용해도 | > 98 % |
| 생체 흡수율 | 94.5% 이상 |
코미녹스는 sodium metaarsenite를 주 효능성분으로 하는 비소계 항암제로, 물에 대한 용해도와 생체 흡수율이 높아 경구용 항암제로 개발되고 있습니다. 지금까지의 전임상/임상 데이터의 안전성 프로필을 비교하면 주사용 제제로 개발된 arsenic trioxide에 비해 뛰어난 안전성을 보여 주었습니다. 전이암 동물모델, 임상의 몇몇 케이스에서 유효성이 확인되고 있습니다.
낮은
부작용
부작용
경구투여의
용이성
용이성
전이암에서의
효능·효과
효능·효과
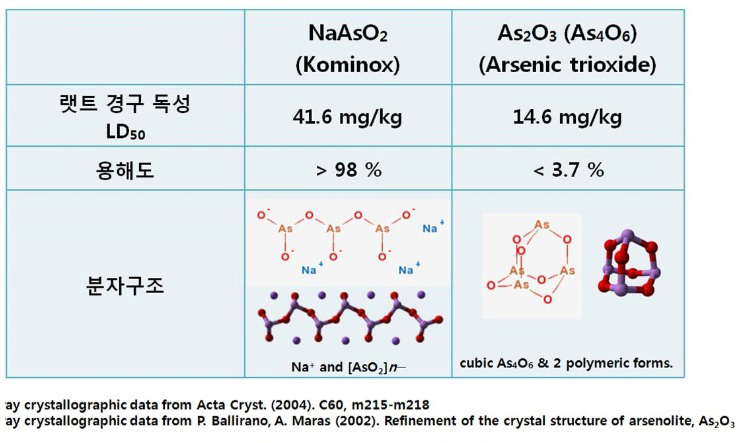
Arsenic trioxide와 비교했을 때 물에 대한 용해도가 매우 높고 상대적으로 안전한 약물입니다. X-ray chrstallography 데이터에 의하면 두 물질은 전혀 다른 분자 구조를 가지고 있습니다.

코미녹스와 삼산화비소의 비교
- 정상세포의 이상 발현으로 변이가 발생된 세포가 암세포 임.
- 초기 종양(암) 형성과정은 정상세포의 염색체 끝에 붙어 있는 텔로미어가 침식되면서 짧아져 변이세포인 암세포가 형성됨.
- 이러한 과정에서 발생된 암세포는 텔로미어가 짧아 곧 사멸할 것 같지만 텔로머라아제라는 효소의 발현으로 계속 분열하면서 유지되는 특성을 갖고 있음
- 암세포의 생성과정을 보면 정상세포의 텔로미어 이상으로 암이 발생된 것이므로 암을 치료하려면 암세포의 텔로미어를 항암요법의 중요한 표적으로 정해야 한다는 것이 코미팜의 주장임.
- 코미팜의 신약(NaAsO2)는 암세포의 염색체 끝에 붙어 있는 텔로미어와 결합하여 암세포를 사멸시키는 기전을 갖고 있음.
- 부작용을 최소화 시키면서 암을 치료할 수 있는 것은 짧은 텔로미어를 갖고 있는 암세포에 감수성이 매우 높지만, 긴 텔로미어를 갖고 있는 정상세포에는 데미지를 주지 않기 때문임.(Telomeric Sequences and Erosion 논문참조)


- 현재의 세포독성 항암제는 주로 성숙 암세포 집단을 사멸시키지만 암 줄기세포를 박멸할 수는 없다. 결과적으로 암은 재발하여 전이암 형태를 띠고 종양은 보다 공격적인 암 줄기세포로 구성된다.
- 전이암을 치료하기 위하여는 성숙 암세포와 암 줄기세포 모두를 제거할 수 있는 치료제가 필수적이다.
- 과학적 연구결과에 따르면 전이암의 생성에 있어 암 줄기세포의 역할은 100%에 가깝다. 당사가 개발하고 있는 코미녹스는 원발성 암에 민감한 암세포들로부터 전이된 전이암들의 암 줄기세포를 99% 사멸할 수 있는 능력을 갖고 있다.
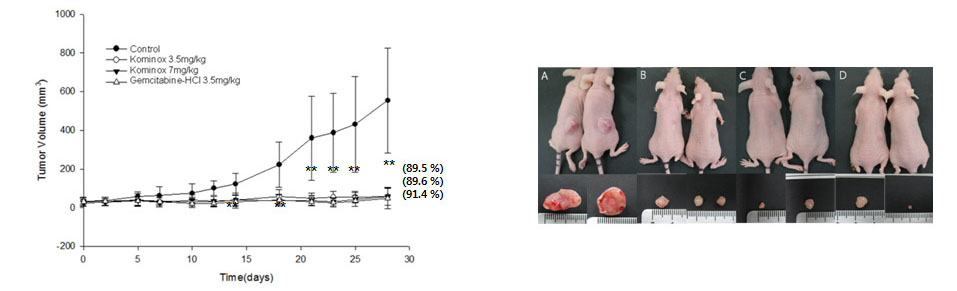
Antitumor effect of kominox in a xenograft nude mouse model

암동물 모델에서 코미녹스의 항암 효과를 확인한 결과입니다.
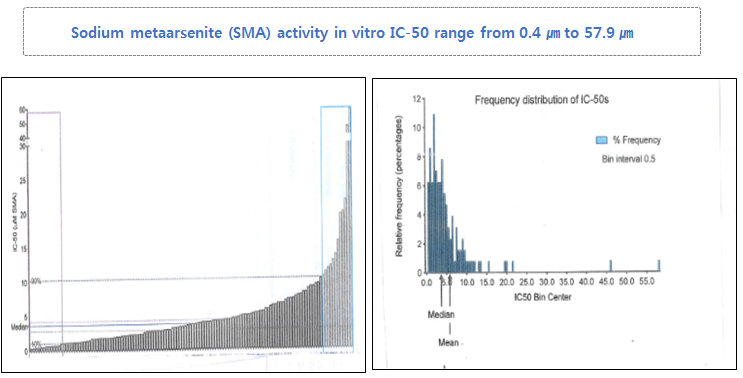
호주의 국영연구기관의 Nano-Technology Testing 방식으로
신약(PAX-1, KML001)의 항암효과 측정을 위하여 실시한 200여개의 암세포 사멸 실험 결과

1뇌전이 폐암을 비롯한 14개 전이암 임상
(PJ Code: PAX-1-003)
2교모세포종 뇌암(GBM) 임상
(PJ Code: PAX-1-002)
(PJ Code: PAX-1-003)
14개 전이암 치료제 개발을 목표로 결정한 이유
- 현재의 세포독성 항암제는 주로 성숙 암세포 집단을 사멸시키지만 암 줄기세로를 박멸할 수는 없다. 암 줄기세포는 고도로 증식하는 암 세포의 창조자(Progenitor)가 될 수 있는 특성을 갖고 있다. 그래서 전이암이나 재발 성 암을 확산시킬 수 있으며 면역계가 있는 포유동물에서 연속적으로 전이를 일으킨다.(KARMANOS 논문 참조)
- 암 줄기세포는 결국 전이암 형태를 띠고, 보다 공격적인 암으로 변신한다. 전이암을 치료하기 위해서는 암 줄기세포를 제거할 수 있어야 한다.
- 코미팜의 과학적 연구결과에 따르면 전이암의 생성에 있어 암 줄기세포의 역할은 100%에 가깝다. 원발성 암에 민감한 암세포들로부터 전이된 전이암들의 암 줄기세포를 99% 사멸할 수 있는 능력을 갖고 있는 코미팜이 개발중인 신약 PAX-1-003이다.(Capacity of Cancer Stem cell ‘KARMANOS 논문참조)
- 2019년 9월(예정)에 실시하는 14개 전이암에 대한 원발성 암들을 나노테크날러지 테스팅 방법으로 사멸효과를 측정 하여 그에 따른 전이암들을 선정하였으므로 암 줄기세포 사멸력에 따라 임상 성공률이 매우 높을 것으로 기대하고 있다.
14개 전이암 치료제 임상시험의 현황
- 2019년 8월 일 미국FDA로부터 14개 전이암을 5개 Cohort로 나누어 동시에 바스캣 임상을 실시하도록 임상시험 승인을 받아 240명의 환자를 대상으로 임상개시 준비를 하고 있음.
- 개 전이암은 뇌전이 비소세포폐암, 림프 전이 비소세포폐암, 전이 유방암, 전이 연조직암, 전이 골육종암, 전이 위암, 전이 신장암, 전이 난소암, 전이 방광암, 전이 자궁경부암, 전이 자궁내막암, 전이 두경부암, 전이 전립선암, 전이 흑색종 암 등을 대상으로 미국을 비롯한 다 국가 임상2상 개시 준비 중임.
- 현재 사용되는 뇌암 관련 치료제 약물은 혈액-뇌장벽(BBB) 통과 율이 매우 저조하여 효과가 미미한 실정임. 뇌 전이 폐암 역시 권장할 만한 치료제가 없다. 코미팜의 PAX-1-003은 혈액-뇌장벽(BBB) 통과 율이 98%이며 뇌에 전달된 약물이 72시간 머물러 있으면서 뇌 전이 폐암 줄기세포를 사멸하는 특성을 갖고 있음.
(PJ Code: PAX-1-002)
교모세포종(GBM)을 개발을 목표로 결정한 이유
- 교모세포종 뇌암(GBM)은 세계보건기구(WHO) 등급 시스템에 따르면 성장속도가 빠르고 위험한 잠재력을 지닌 가장 악성도가 높은 등급 4로 분류되어 있음.
- 교모세포종 뇌암(GBM)은 뇌 신경에 붙어 있는 암으로 신경을 건드리면 안됨으로 수술 및 방서선 치료를 하여도 암 세포가 남아 있게 되어 반드시 재발할 수 밖에 없어 약물로 만이 완치가 가능함.
- 포유동물에는 혈액-뇌장벽(BBB)이 존재하여 약물이 뇌로 가는 것을 차단하고 있음. 현재 표준치료제로 사용하는 Temozolomide(TMZ)도 혈액-뇌장벽(BBB) 통과 율이 20~30% 도달하는 정도로 한계가 있음.
- 코미팜의 신약 PAX-1-002는 혈액-뇌장벽(BBB) 통과 율은 98% 임. 이렇게 통과하는 이유는 비소(As)가 사람의 몸에 필수적인 원소이기 때문으로 추정. (미국소재 MDS Pharma Services실험결과 참조)
- 코미팜의 개발 신약 PAX-1-002는 표준치료제로 사용하고 있는 TMZ치료제에 전혀 반응이 없는 암세포에도 사멸효과가 우수함을 확인함.
- 가장 많이 발생하는 GBM 암세포를 대상으로 PAX-1-002를 나노테크날러지 테스팅으로 사멸효과를 확인한 결과 4개의 암세포에서 저 용량으로 사멸효과가 있음을 확인함.
- 따라서 향 후 교모세포종 뇌암(GBM) 치료에 있어 PAX-1-002가 표준치료제로 지정될 확률이 높음.
교모세포종(GBM) 임상 설명
- 교모세포종 뇌암(GBM) 임상을 호주 시드니 소재 Prince Wales Hospital과 Scientia Clinical Research(주정부 설립 및 소유) 공동으로 임상을 진행하고 있음.
- 임상 책임자는 교모세포종 뇌암(GBM)의 수술에서 세계적 명성을 얻고 있는 찰리테오 박사 임상 부책임자는 미국에서 교모세포종 뇌암(GBM) 수술을 3천건 이상 경험하고 있는 마이클 서구루 박사와 Scientia Clinical Research의 종양내과 전문의사 3명이 참여하고 있음.
- 교모세포종 뇌암으로 진단 받은 신규환자를 대상으로 실시하는 임상으로 완치 가능성이 높아 큰 관심과 기대가 있음.
- 교모세포종 뇌암으로 수술 후 재발한 환자를 대상으로 실시하는 임상으로 표준치료제와 생존율 비교 목적도 있음.
- 교모세포종 뇌암(GBM) 임상은 신규진단 교모세포종 환자 40명, 수술 후 재발한 교모세포종 환자 40명 총 80명을 대상 으로 실시하는 임상으로, 임상 중에 중간 결과로 미국 FDA에 ODD신청계획에 있으며, 미국FDA와 판매허가 절차 과정 중 임상환자가 증가 할 수 있음.
- 교모세포종 뇌암은 미국에서만 년 19,000명 정도가 발생하며, 병의 증세가 매우 좋지 않은 암으로 희귀질환(Orphan Drug)에 해당함.
- 코미팜은 GMP 공장건설 및 설비가 완료됨.
- 따라서, 판매승인 허가를 받는 대로 각 국가별 대리점 모집과 매출이 원활하게 진행 될 수 있는 장점을 갖고 있음.